|
Cardiomyopathie
Hypertrophique
La Cardiomyopathie Hypertrophique
est caractérisée par un
épaississement plus ou moins
important du muscle cardiaque,
appelé hypertrophie. La
distribution de cet
épaississement est variable d'un
chat à l'autre. Cette
hypertrophie touche
principalement le ventricule
gauche et dans une moindre
mesure le ventricule droit.
Cette maladie cardiaque affecte particulièrement le maine coon, le persan
(et type persan) et le chat de
gouttière (source AJVR, Vol. 65
N° 5, May 2004).
Toutefois, le sphynx n'en est pas exempt, et un certain nombre de cas de
CMH ont été détectés chez des
reproducteurs, dans le monde
entier, suffisamment pour que
les éleveurs de sphynx prennent
conscience du risque que
représente cette maladie pour la
race, et commencent à s'en
préoccuper avant qu'elle ne
prenne des proportions
alarmantes.
Les estimations récentes, obtenues grâce à la transparence des éleveurs,
particulièrement des éleveurs
américains, très ouverts sur ce
sujet, font état d'une
estimation de 10 à 15 % environ,
de sphynx touchés par la
cardiomyopathie hypertrophique.
Le dépistage de la CMH devient donc une étape indispensable pour tout
éleveur de sphynx.
Nous nous tenons à votre disposition, pour toute question que vous vous
poseriez
et pour vous guider dans votre
démarche de dépistage.
La cardiomyopathie hypertrophique est une maladie incurable, à évolution
plus ou moins rapide. Un chat
atteint peut cependant vivre de
nombreuses années, à condition
d'être correctement suivi et
sous traitement. Il n'est pas
possible actuellement de
déterminer l'espérance de vie
d'un chat CMH.
Chez le maine
coon, la maladie est souvent
dépistée chez de jeunes sujets
(parfois moins d'un an), et
l'évolution est très rapide.
Chez le sphynx, elle est plus fréquemment dépistée suite à l'apparition
tardive d'un souffle cardiaque
(vers 3, 4 ou 5 ans), mais on
note des cas de sphynx positifs
CMH, âgés de plus de 10 ans et
demeurant en très bonne
condition physique, grâce à un
traitement adapté et à un
dépistage précoce.
La CMH doit être considérée
comme une maladie génétique.
Elle est la conséquence de la
survenue d'anomalies sur les
chromosomes responsables de la
fabrication des différentes
protéines constituant le muscle
cardiaque. Elle est transmise
par les géniteurs dans 70% des
cas.
En l'état actuel des recherches, le gène responsable de la maladie chez
le maine coon a été identifié
comme étant d'allèle dominant à
pénétration incomplète. Il
existe actuellement une forte
suspicion pour qu'il en soit de
même chez le sphynx.
« Dominant » signifie textuellement, qu'un seul porteur du gène
déclenchant la maladie est
nécessaire pour la transmission
à une partie de la portée (un
gène d'allèle récessif doit lui,
être porté par les deux parents
pour être transmis à la
descendance).
« Pénétration incomplète » signifie qu'un chat peut être porteur de
l'anomalie génétique responsable
de la CMH, mais sans lui-même
développer la maladie. Par
contre, il transmettra ce gène à
ses chatons, qui eux, pourront
développer une cardiomyopathie
hypertrophique. C'est pour cette
raison que l'on peut constater
un développement de la maladie,
sur des chats issus de parents
déclarés indemnes au dépistage.
A l'heure actuelle, il n'existe pas encore de test génétique permettant
un dépistage précoce avant que
la maladie ne se déclare et
permettant de dépister les «
porteurs sains ».
Afin de déterminer le mode de transmission, chez le sphynx, le Sphynx
Club de France a entamé des
démarches auprès de Maison
Alfort, dans le cadre d'une
consultation génétique. Nous
vous tiendrons informés et le
concours des éleveurs sera très
important.
Autres noms de la maladie: Cardiomyopathie hypertrophique, primitive ou
idiopathique ; Myocardiopathie
hypertrophique ; Cardiomyopathie
obstructive ; Sténose sous
aortique.
De quelle manière
la C.M.H. affecte le coeur ?
Pour mieux comprendre cette maladie, il vaut la peine de se familiariser
avec la structure et la fonction
normale du coeur.
Structure du
coeur
La 1ère figure schématise en coupe un cœur normal composé de 4 cavités
(deux oreillettes et deux
ventricules) séparées par 2
valves (mitrale et tricuspide).
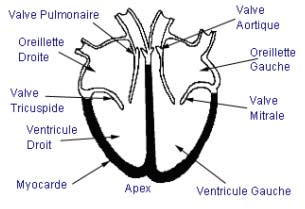
Le sang arrive dans les oreillettes par les veines (veines caves dans
l'oreillette droite, veines
pulmonaires dans l'oreillette
gauche). Les veines pulmonaires
sont de petite taille.
Il quitte les ventricules par deux grosses artères (aorte et artère
pulmonaire) après avoir franchi
deux valves (respectivement la
valve aortique et la valve
pulmonaire).
Les parois du cœur sont composées d'un muscle spécialisé que l'on nomme
myocarde. C'est cette partie du
coeur qui est affectée dans le
cadre d'une CMH.
Fonctions du
coeur
Le flux sanguin circule dans le cœur de la manière suivante :
-
ü
Le sang qui a libéré son
oxygène dans les tissus
remonte vers le cœur par le
système veineux - veines caves
- et se jette dans
l'oreillette droite.
-
-
ü
Il se déverse dans le
ventricule droit en passant
par la valve tricuspide, puis
est éjecté lors de la
contraction du ventricule
droit dans l'artère pulmonaire
à travers la valve du même
nom.
-
-
ü
Une fois oxygéné dans les
poumons, le sang revient dans
l'oreillette gauche par les
veines pulmonaires.
-
-
ü
Après avoir traversé la valve
mitrale, il remplit le
ventricule gauche qui va
l'éjecter dans l'aorte à
travers la valve aortique pour
aller irriguer les tissus.
Commence alors un nouveau
cycle.
|
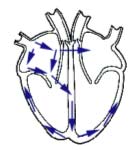 |
Chaque battement de coeur est généré par un signal électrique.
Ainsi que l'illustre la figure ci-contre, le signal démarre au sommet du
coeur et se propage vers la
pointe en le traversant
entièrement (les flèches
bleues montrent le sens de
propagation du signal
électrique).
Les anomalies du muscle cardiaque rencontrées lors de Cardiomyopathie
(Obstructive ou non
obstructive) peuvent parfois
s'accompagner d'une
altération de la propagation
du signal électrique. |
Plusieurs types d'Hypertrophie
|
|
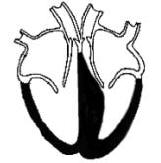
Dans
la plupart des cas,
l'hypertrophie ne touche
qu'une portion du muscle, et
tout particulièrement le
septum interventriculaire
qui est la paroi musculaire
séparant le ventricule
gauche du ventricule droit.
Cette forme de CMH est
appelée
"Hypertrophie
Septale Asymétrique".
(cf. figure ci-contre).
Dans de rare cas (2 % des cas), l'épaississement musculaire se répartie
régulièrement tout autour du
ventricule. On parle alors
d' "Hypertrophie
Ventriculaire Symétrique".
Enfin, l'épaississement du myocarde peut également être localisé à la
pointe du cœur ou apex dans
près de 2% des cas. On parle
alors de «
forme apicale
». |
Les formes
obstructives
Dans près de 20-25% des cas, cette hypertrophie est associée à une gêne à
l'éjection du sang dans l'aorte.
On parle alors de «Cardiomyopathie Hypertrophique
Obstructive».
Le principe en est le suivant. Au moment où le ventricule gauche éjecte
le sang vers l'aorte, la valve
mitrale est aspirée dans le flux
et projetée contre le septum
épaissi. Elle contribue ainsi à
rétrécir la portion de
ventricule que le sang doit
franchir avant d'être éjecté
dans l'aorte, réalisant ainsi
une obstruction à l'éjection.
Cette obstruction, qui peut être
plus ou moins sévère, oblige le
ventricule gauche à fournir un
effort supplémentaire pour
chasser le volume de sang
nécessaire au besoin de
l'organisme.
Ce rétrécissement est responsable de turbulences causées par
l'accélération du sang à travers
cet obstacle. Ces turbulences
sont à l'origine du « souffle
cardiaque » particulier (souffle
systolique basal gauche), qui
peut être détecté par le
stéthoscope.
Enfin, le déplacement anormal de la valve mitrale s'accompagne souvent
d'une perte d'étanchéité de
cette structure. Une quantité
plus ou moins importante de sang
va alors refluer dans
l'oreillette gauche en direction
des poumons. On parle alors de
"régurgitation mitrale", qui
elle aussi peut être détectée à
l'auscultation cardiaque
(souffle systolique apexien
gauche).
Les effets sur le
muscle cardiaque
Le muscle hypertrophié se contracte le plus souvent normalement, voire
avec excès. Par contre, il a de
la peine à se remplir car il est
trop rigide et se relâche mal
après la contraction. Dans un
premier temps, les conséquences
de ce mauvais remplissage
n'apparaissent le plus souvent
pas au repos ou pour des efforts
simples.
Par contre, lors d'efforts importants, le cœur ne pourra pas augmenter la
quantité de sang nécessaire à
l'activité musculaire car sa
cavité n'accepte qu'une quantité
fixe de sang.
Si le défaut de remplissage est trop important, le sang stagne dans les
vaisseaux pulmonaires et fait
augmenter la pression dans les
tissus. Si la pression est trop
élevée, l'eau envahit les
poumons. On parle alors d'œdème
pulmonaire.
Le muscle est également trop épais pour le nombre de vaisseaux
coronaires. De plus, les petites
artères ne peuvent pas se
dilater lors d'efforts ainsi
qu'elles devraient le faire.
Les fibres
musculaires
|
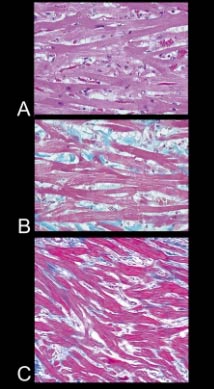 |
Au microscope, le cœur
atteint de CMH présente les
caractéristiques suivantes.
Les fibres ne sont pas
alignées en parallèle mais
de manière chaotique. On
parle de désorganisation
cellulaire ("myocardial
disarray")
Ci-contre, ces images illustrent la désorganisation chaotique des fibres
musculaires cardiaques (qui
sont obliques voire
perpendiculaires les unes
par rapport aux autres, et
non orientées parallèlement
comme dans un muscle sain).
A et B sont des images du septum interventriculaire du même chat et C
montre la paroi
ventriculaire droite d'un
autre animal atteint de
myocardiopathie
hypertrophique.
A : Coloration à l'hématoxyline et éosine, et B, C : Coloration
trichromique de Masson
(collagène en bleu, fibres
musculaires en rouge).
Agrandissement x 40
De plus, le tissu amorphe situé entre les fibres contractiles prolifère,
augmentant progressivement
la rigidité du muscle. On
parle alors de "fibrose
interstitielle" (bien
visible sur les 3 images A à
C). |
(Source : Journal of Veterinary
Cardiology Vol. 5, N°2, November
2003 – Hypertrophic cardiomyopathy – Clinical and
pathologic correlate – Philip R.
Fox
Une dégénérescence des valves atrio-ventriculaires (valve mitrale
notamment) est fréquemment
associée, de même que des
lésions dégénératives des
artères coronaires contribuant
ainsi à l'hypoxie myocardique.
Ci-après
schéma comparatif entre un cœur
normal et un cœur touché par la
CMH :
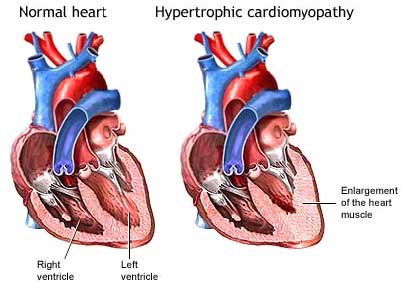
(Source : Medical encyclopedia,
ADAM.Inc – H. Jacqueline Suk, MD
– Boston)
Ci-après, photos de coupes de
cœurs touchés par la CMH. Notez
l'épaississement impressionnant
du myocarde, qui donne un aperçu
des conséquences sur le
remplissage.
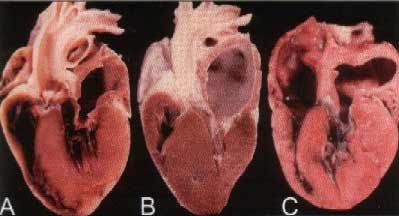
(Source : Journal of Veterinary
Cardiology Vol. 5, N°2, November
2003 – Hypertrophic
cardiomyopathy – Clinical and
pathologic correlate – Philip R.
Fox)
Les symptômes de
la C.M.H.
Les symptômes classiques de la CMH sont, par ordre d'importance :
-
ü
Essoufflement à l'effort,
difficulté respiratoire
(dyspnée), fatigabilité
-
ü
Anomalie auscultatoire :
Souffle au cœur, bruit de
galop, arythmie
-
ü
Abattement, toux
-
ü
Vertiges, pertes d'équilibre
ou même de connaissance
(syncopes)
Aucun de ces symptômes n'est spécifique de la CMH et peuvent se
rencontrer avec d'autres
maladies cardiaques.
Ces symptômes apparaissent le plus souvent lorsque le chat est âgé de 5
ans. Certains chats peuvent
toutefois avoir des symptômes
plus précoces.
Beaucoup de chats sont peu ou modérément gênés par cette maladie. Mais
sans traitement, l'évolution est
rapide et mène à la mort du
chat.
Le despitage de
la C.M.H.
Le diagnostic n'est pas facile à établir, le chat ne présentant pas
forcément de symptômes
apparents. C'est un examen
clinique par le vétérinaire
habituel, (mais qui n'a pas
valeur de diagnostic de CMH) qui
permet d'établir une suspicion
de trouble cardiaque par la
découverte d'une anomalie
auscultatoire (exemple souffle).
Attention toutefois, un souffle
au cœur n'est pas pour autant
synonyme de CMH et inversement
une CMH peut s'accompagner d'une
auscultation cardiaque
parfaitement normale !
Après la découverte chez un chat adulte, d'un souffle cardiaque apparu
soudainement, il est cependant
vivement conseillé d'effectuer
un dépistage par le biais d'une
échocardiographie qui reste
actuellement le meilleur examen
diagnostic de CMH.
L'examen
écho-Doppler cardiaque
Il s'agit d'un examen indolore qui
consiste à appliquer sur le
thorax du chat une sonde
émettrice et réceptrice
d'ultrasons.
Le principe est le
même que celui qui est utilisé
pour visualiser les bébés dans
le ventre de leur mère.
Cet examen permet la visualisation du muscle cardiaque
(évaluation qualitative de son
aspect, mesure précise de son
épaisseur en systole et
diastole, étude de sa
cinétique). Il permet également
de déterminer la taille des
cavités et évaluer l'aspect des
valves.
L'effet Doppler, permet de mesurer la vitesse du flux
à travers les valves et estimer
la pression qui règne dans les
cavités cardiaques. On peut
également contrôler l'étanchéité
des valves.
Dans le
cas de la CMH, cet examen va
permettre de mettre en évidence
l'épaississement très
caractéristique du septum ou de
la paroi du ventricule gauche
ainsi que révéler la présence
d'une obstruction sous-aortique.
Ci-après, cliché
d'échocardiographie de CMH
féline : Coupe grand axe en mode
2D.
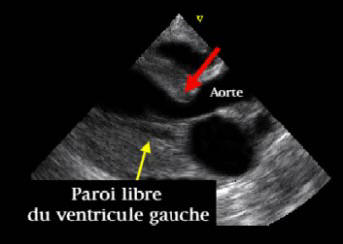
Ce cliché montre que le septum en région sous aortique (flèche rouge) est
épaissi à l'origine d'une
obstruction.
La paroi libre du ventricule gauche n'est pas
épargnée.
(Source : Cliché PR. V. Chetboul,
Unité de Cardiologie d'Alfort)
Ci-après, cliché de coupe
transversale transventriculaire
en mode 2D de CMH féline :
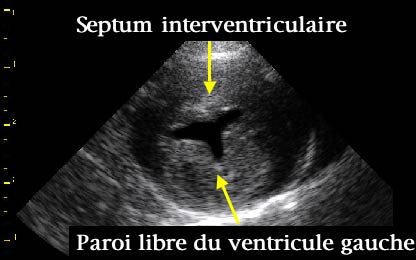
Le septum et la paroi libre sont hypertrophiés de façon symétrique.
(Source : Cliché PR. V. Chetboul,
Unité de Cardiologie d'Alfort)
|
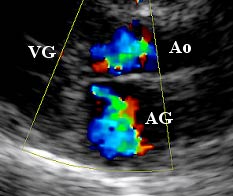 |
Le cliché ci-contre montre
un exemple d'anomalies
détectées en mode Doppler
couleur (chat atteint de CMH
obstructive) : la tâche en
couleur en haut de l'image
correspond aux turbulences
du sang traversant la région
sous-aortique rétrécie.
La deuxième, en dessous, correspond à la visualisation du sang refluant
du ventricule gauche dans
l'oreillette gauche (fuite
mitrale).
(Source : Cliché PR. V.
Chetboul, Unité de
Cardiologie d'Alfort) |
D'autres techniques ultrasonores se développent mais
sont actuellement réservées à
des structures de pointe,
notamment de recherche (Unité de
cardiologie de l'ENV Alfort).
Nous parlerons plus particulièrement de la technique
de Doppler Tissulaire.
L'échographie
Doppler Tissulaire (Doppler
tissue imaging, DTI) :
Cette technique déjà appliquée en cardiologie humaine, présente l'intérêt
de permettre de mesurer la
vitesse de déplacement des
parois myocardiques tout au long
du cycle cardiaque et de
détecter précocement toute
anomalie du fonctionnement du
myocarde (altérations
myocardiques) qui pourrait alors
induire ou confirmer un
diagnostique de suspicion de CMH,
même lorsque l'écho Doppler
traditionnel ne montre pas
encore de dysfonction évidente.
La supériorité du DTI par rapport à l'échocardiographie conventionnelle a
été démontrée chez le chien dans
un modèle canin de
cardiomyopathie dilatée. Cette
technique est à l'heure
actuelle, testée à une échelle
plus large en pathologie
spontanée canine
(myocardiopathie dilatée) et
féline (cardiomyopathie
hypertrophique), dans l'Unité de
Cardiologie d'Alfort.
Dans ces deux affections, des résultats préliminaires semblent indiquer
que la sensibilité diagnostique
et pronostique du DTI est
supérieure à celle de
l'échocardiographie Doppler
classique.
(Source : Cahier du Vétomecum –
Compte-rendu de la conférence du
Pr. Valérie Chetboul «
L'imagerie cardiovasculaire du
futur en médecine vétérinaire »)
Les traitements
proposés dans le cadre de la
C.M.H
S'il existe pour les humains, des options chirurgicales (Myotomie-myectomie
septale, alcoolisation septale,
pose de stimulateur cardiaque)
dans le traitement pour la CMH,
les traitements proposés pour
améliorer le confort de vie des
chats atteints sont, à l'heure
actuelle, essentiellement
médicamenteux :
C'est d'une façon générale le traitement de l'insuffisance cardiaque
vasodilatateur, IECA, diurétique
et si nécessaire, antiarythmique
pour améliorer le confort de vie
du chat; et en traitement de
fond le traitement spécifique de
la maladie musculaire. Les IECA
en plus de leur action
vasodilatatrice bénéfique dans
l'insuffisance cardiaque, ont
aussi des effets myocardiques
intéressants : effet
anti-hypertrophique, effet
anti-remodelage, effet
anti-ischémique.
Les antagonistes du calcium dits inhibiteurs calciques, comme le
diltiazem, ont des effets
bénéfiques lors de MCH :
propriétés anti-arythmiques mais
aussi effets ciblés sur le
myocarde (amélioration du
remplissage cardiaque, effet
anti-hypertrophique direct,
effet anti-ischémique, action
favorable sur la relaxation
myocardique).
Les anti-arythmiques
stricto sensu
sont des substances qui
stabilisent / régulent
l'activité électrique des
cellules du muscle cardiaque.
Ils sont en priorité administrés
aux chats chez lesquels des
troubles du rythme ont été
constatés.
Pour certains d'entre eux, cependant rarement utilisés chez le chat (plus
chez l'homme), quelques effets
indésirables sont à déplorer,
tels que des troubles digestifs,
des troubles visuels, une
hypersensibilité au soleil
(attention aux sphynx qui
s'exposent au soleil) et des
allergies cutanées.
Tous ces effets indésirables sont toutefois réversibles mais un contrôle
chez un vétérinaire
ophtalmologue est recommandé si
apparaît le moindre doute de
problème affectant la vision du
chat.
Les diurétiques sont des médicaments favorisants l'élimination d'eau par
voie urinaire (augmentation de
la diurèse). Ils ne sont
indiqués que chez les chats
insuffisants cardiaques (c'est à
dire présentant un œdème
pulmonaire, une ascite ou un
épanchement pleural).
Les anticoagulants (aspirine surtout) sont des substances qui fluidifient
le sang et limitent les risques
de constitution de caillots. Ils
sont fortement recommandés
lorsque le chat souffre
d'épisodes de fibrillation
auriculaire ou lors de
dilatation atriale jugée
importante par l'échographiste).
N.B : Certains médicaments peuvent aggraver une forme obstructive. Il est
donc important, si vous
consultez un autre vétérinaire
que votre praticien habituel, de
l'informer de l'existence de la
maladie de votre chat et de son
traitement, afin d'éviter un
effet secondaire.
De manière générale, il faut
éviter d'administrer à votre
chat, tout autre médicament que
celui que votre vétérinaire aura
prescrit, sans le consulter.
Nous tenons à adresser nos
remerciements les plus
respectueux au Professeur
Valérie Chetboul, (Agrégé de
Pathologie Médicale - Diplomate
ECVIM-CA, Cardiology Unité de
Cardiologie de l'Ecole
Vétérinaire d'Alfort, UP de
médecine) pour l'aide précieuse
qu'elle nous a apportée en ayant
bien voulu relire et corriger ce
dossier, ainsi que pour la
documentation fournie."
Copyright SC
Fais le 25 novembre 2009
|
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()